
Title: Partículas sub-atómicas: el electrón
Other Placeholder: Los rayos son desviados por la placa positiva, por tanto tienen carga negativa (Thomson)

Title: Partículas sub-atómicas: el electrón
Other Placeholder: Los rayos son capaces de mover un aspa, por tanto tienen masa (Thomson)
Los rayos proyectan una sombra cuando se interpone un objeto en su trayectoria, por tanto viajan en línea recta

Title: Partículas sub-atómicas: el electrón
Other Placeholder: Thomson pensó que la radiación estaba constituida por partículas con masa, cargadas con electricidad negativa.
Los rayos eran siempre iguales cualquiera que fuera la sustancia introducida en el recipiente. Thomson dedujo que estas partículas se encontraban en el interior de toda la materia
Calculó la relación carga/masa de las partículas demostrando que eran de menor tamaño que los átomos. Eran electrones.

Title: El modelo atómico de Thomson
Other Placeholder: El átomo contiene partículas subatómicas;
Algunas de estas partículas (electrones) poseen carga eléctrica negativa y masa;
El resto del átomo posee carga positiva y contiene la mayor parte de la masa del mismo;
El átomo es eléctricamente neutro así que el numero de cargas positivas debe ser igual al de negativas.

Title: El modelo atómico de Thomson
Thomson imagino el átomo como una especie de bizcocho con pasas, como una esfera positiva continua en la que se encuentran embebidos los electrones.

Title: Experimentos de Rutherford

Title: El modelo atómico nuclear de Rutherford

Title: El modelo atómico nuclear de Rutherford
Other Placeholder: El átomo es un espacio fundamentalmente vacio formado por:
Corteza:
Electrones girando a gran distancia del núcleo
Masa muy pequeña y carga eléctrica negativa
Núcleo:
Contiene casi toda la masa del átomo
En él se encuentra toda la carga positiva.

Title: El modelo atómico nuclear de Rutherford
Other Placeholder: Rutherford postulo la existencia de otras partículas subatómicas:
Protones: de masa igual a la del átomo de hidrógeno y carga igual a la del electrón pero positiva (Rutherford demostró su existencia)
Neutrones: otra partícula con la misma masa del protón pero sin carga eléctrica (Chadwick confirmó su existencia 20 años después)

Title: El modelo atómico nuclear de Rutherford

Title: El modelo atómico nuclear de Rutherford
Other Placeholder: Rutherford determinó que el tamaño de los radios atómicos era del orden de 10-10 m y el del núcleo atómico del orden de 10-14 m.
Por tanto el radio del núcleo es 10000 veces mas pequeño que el átomo.
Los átomos son esferas casi vacías
Unidades: El Angstrom (Å) es un submúltiplo del metro del mismo orden de magnitud que los átomos.
1 Å = 10-10 m

Title: Propiedades de las partículas subatómicas
*u: unidad de masa atómica (masa del átomo de hidrógeno)
1 unidad de masa atómica = 1,6 x 10-24 gramos

Title: Características de los átomos
Other Placeholder:
1. Todos los átomos son neutros, por tanto han de tener el mismo numero de cargas positivas que negativas

Title: Características de los átomos
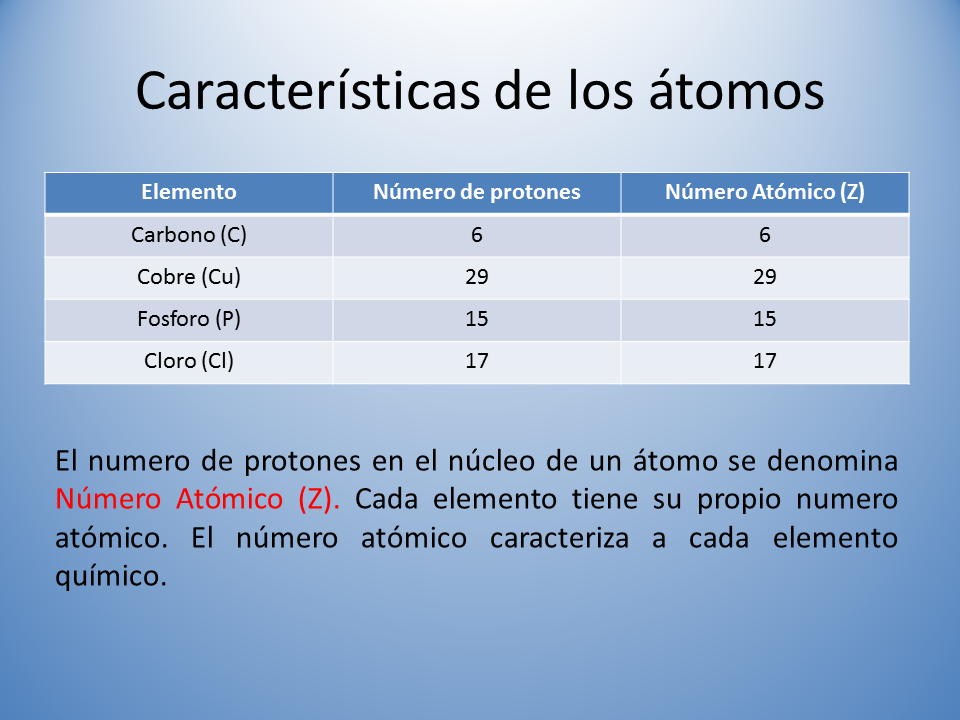
Title: Características de los átomos
El numero de protones en el núcleo de un átomo se denomina Número Atómico (Z). Cada elemento tiene su propio numero atómico. El número atómico caracteriza a cada elemento químico.

Title: Características de los átomos
Other Placeholder: El número de masa de un átomo se calcula sumando el número de protones con el número de neutrones (la masa de los electrones es casi despreciable y la masa de protones y neutrones es 1). A este numero se le llama Número de Masa o Número Másico (A).
Número Másico = N° protones + N° neutrones
A = Z + N

Title: Características de los átomos
Other Placeholder: Representación de los átomos de un elemento:
Número de Masa
AZX Símbolo del elemento
Número Atómico

Title: Características de los átomos
Other Placeholder: A través de esta representación podemos obtener mucha información:
El nombre del elemento
Su número atómico (número de protones y electrones)
Su número de masa
Su número de neutrones
La posición del elemento en la tabla periódica (ordenados por número atómico).

Title: Características de los átomos
Other Placeholder: N° neutrones = 10
A = N° protones + N° neutrones = 19
199F Flúor
Z = N° protones= 9
N° electrones = 9

Title: Masa atómica relativa
Other Placeholder: Escala de masas atómicas relativas.
La unidad de masa atómica (u) es la masa del átomo de Hidrógeno, H.
Así, la masa del átomo de azufre es 32 porque es 32 veces más pesado que el átomo de hidrógeno y la del oxígeno es 16 porque es 16 veces más pesado que el átomo de hidrógeno.

Title: Masas moleculares
Other Placeholder: La masa de una molécula se calcula sumando las masas de los átomos que la forman. También se expresan en unidades de masa atómica (u).
Masa de CO2:
Masa Carbono = 12
Masa Oxígeno = 16
Masa Dióxido de Carbono:
Masa CO2= 12 + 16 x 2 = 44

Title: Isótopos
Other Placeholder: No todos los átomos de un elemento tienen el mismo número másico, aunque todos tienen el mismo número de protones (Z).
Isótopos son átomos de un mismo elemento que tienen distinto número de neutrones.
Algunos isótopos son radiactivos: 131 I, 14C.

Title: Isótopos del Hidrógeno

Title: Isótopos del Carbono

Title: Modelo de Bohr
Other Placeholder: (explicó la estructura del átomo de Hidrógeno)
los electrones se mueven en órbitas estables
El electrón tiene en cada órbita una determinada energía, que es tanto mayor cuanto mas alejada este la órbita del núcleo.
Cuando el electrón salta de un estado de mayor energía a otro de menor energía, esta energía se libera

Title: Modelo de Bohr

Title: La distribución de electrones
Other Placeholder: Los electrones están distribuidos en capas o niveles de energía (n = 1,2…7). En cada una de ellas se sitúa un numero máximo de electrones:.

Title: Configuración electrónica
Other Placeholder: Hay restricciones que afectan al número de electrones que pueden ocupar una determinada capa: cuando la tercera tiene 8 electrones, comienza a llenarse la cuarta, a pesar de que la tercera admite hasta 18 electrones.
Esta distribución por capas se conoce como la configuración electrónica del elemento.
A los electrones en la ultima capa se les llama electrones de valencia y son los responsables de las propiedades químicas de las sustancias.

Title: Como se dibujan los átomos

Title: Configuración electrónica
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |